吴方课题组在化学生物学知名期刊ChemBioChem发表应邀综述
日前,应欧洲化学出版协会与Wiley-VCH杂志社化学生物学知名期刊ChemBioChem执行主编Dr. Ragg邀请,吴方课题组发表了题为“The Multiplicity of Polypeptide GalNAc-Transferase: Assays, Inhibitors and Structures” 的应邀综述。
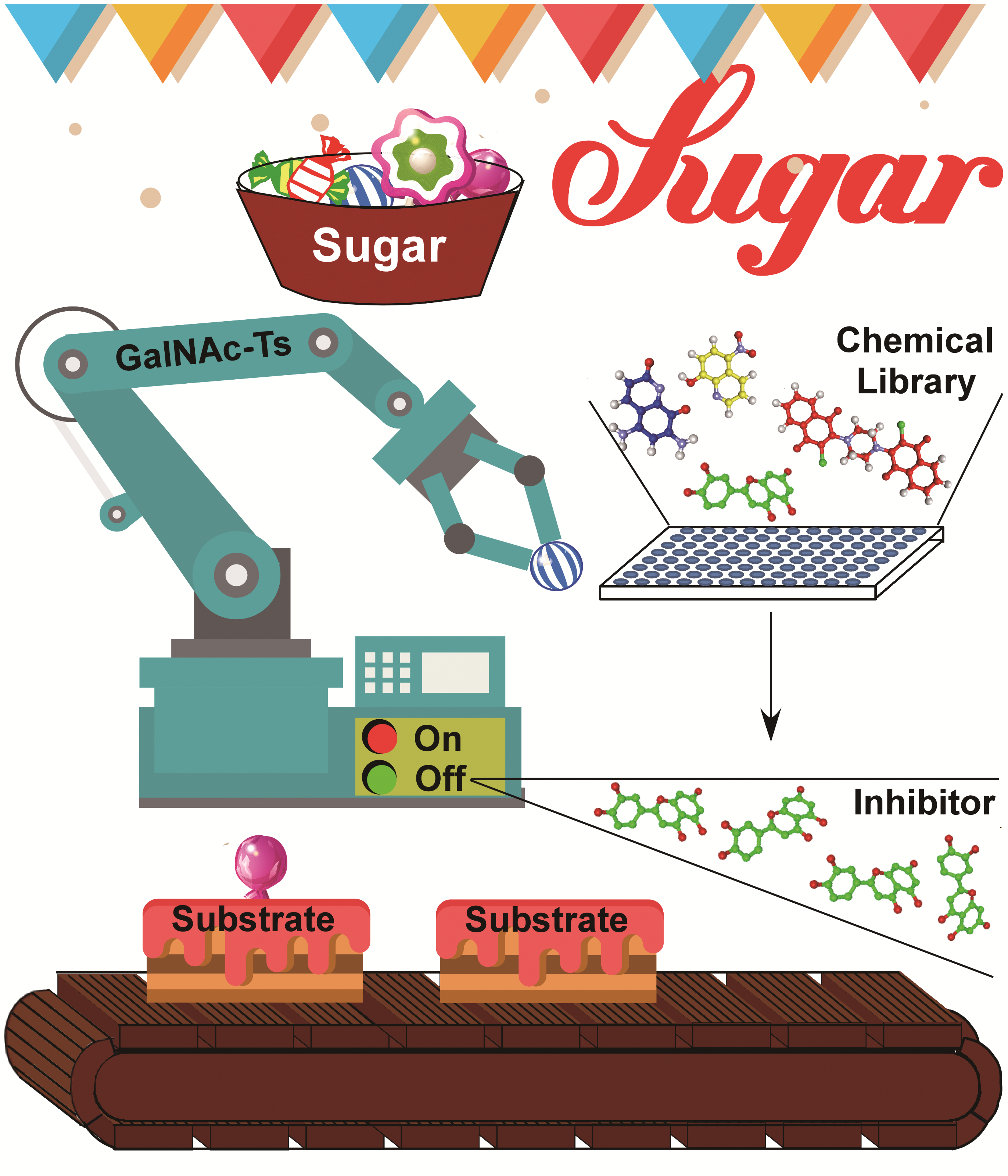
该论文系统性地回顾和归纳了自上世纪70年代以来,各领域专家在蛋白质O糖基化酶Polypeptide GalNAc-Transferase (GalNAc-T )催化机制、酶活检测方法、小分子抑制剂和高级晶体结构所取得的研究进展。通过总结和思考这些知识,以及该酶3D结构重叠比较,作者率先提出了GalNAc-T酶活调控的新型分子机制,为解决GalNAc-T酶的催化机制、其与多肽底物和小分子抑制剂的相互识别和选择性等科学问题提供了原创性的观点和科学假设。该43页综述,包含9张图表,查阅了数百篇相关文献,索引文献达106篇。
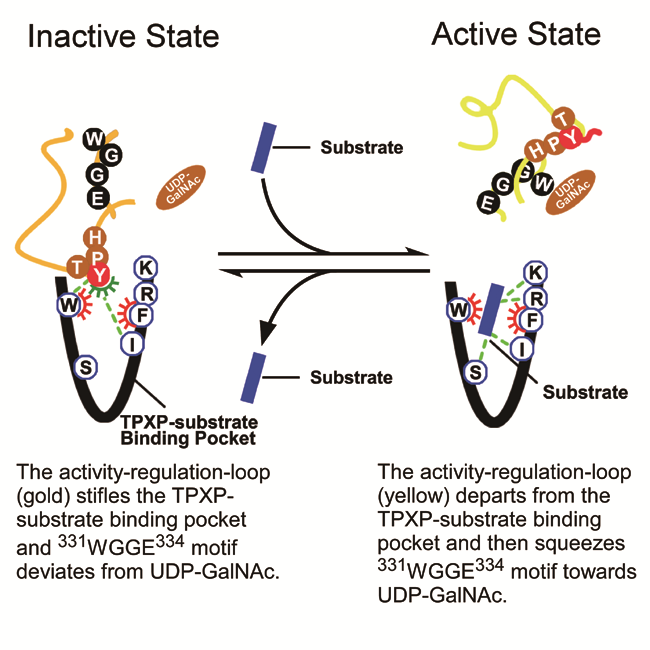
本综述中,作者提出,GalNAc-T酶自身结构中就存在活性调节元件(activity-regulation-loop)以及底物结合口袋(TPXP-substrate binding pocket),其对于酶的活力调节以及酶对底物和小分子抑制剂的识别极为重要。活性调节元件、底物以及小分子抑制剂都能够与底物结合口袋的特异残基相互作用,从而决定了GalNAc-T酶的功能和活化状态。当活性调节元件占据结合口袋时,GalNAc-T酶的催化WGGE残基远离底物供体UDP-GalNAc的位置,而使得酶呈现出失活态。而底物或者底物竞争型小分子抑制剂的进入,会使得活性调节元件远离底物结合口袋,并且其末端呈现高度alpha螺旋化,从而将酶的WGGE元件挤压至UDP-GalNAc周围而开启催化反应,使酶处于激活态。与不同亚型的GalNAc-T底物结合口袋的亲和力,决定了不同底物以及抑制剂对该酶不同亚型的选择性。这些新理论的提出也为研发靶向GalNAc-Ts酶的特异药物先导物提供了新的思路和理论基础。
该综述论文由吴方课题组应邀独立完成,胡有天助理研究员为第一作者,吴方研究员为通讯作者,冯娟博士研究生参与了论文材料整理和部分撰写工作。该研究结果于2018年8月27日在线发表(https://www.ncbi.nlm.nih.gov/pubmed/30152088),得到国家重点基础研究发展计划973计划(2012CB822103)和国家自然科学基金青年基金(31500635)的经费支持。吴方课题组正应用这一新理论,开展该类酶的结构功能、特异抑制剂和新底物寻找的研究工作中。该综述论文也被X-MOL重点介绍!