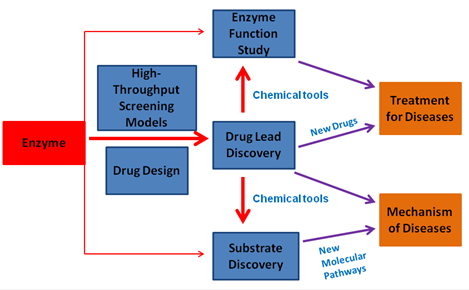
研究方向 (四个):
小分子药物和酶靶点
目前市售的小分子药物约有1500多种,占FDA批准药物的80%左右。317种小分子药物的靶点是蛋白酶类,约占总药物靶点的22%。因此,发现蛋白酶的抑制剂或激活剂对疾病的治疗至关重要。
我们实验室利用生物化学、高通量筛选和药物设计等研究手段去发现蛋白酶的小分子调控物,试图为相关疾病治疗提供小分子药物先导物和分子探针工具。这些调控剂可以作为药物先导化合物以及用于阐明疾病机理的化学探针工具。目前,本实验室已针对多种蛋白酶发现了高效的小分子抑制剂。针对肿瘤的新型靶点CBS(一种维生素B6依赖酶)得到第一个特异抑制剂 (Wang l et al, Cell Death and Disease 2018; Zhou Y. et al, Chem. Comm. 2013)。该抑制剂是目前该抑制剂为最高效的CBS抑制剂,且可高效抑制肝癌异种移植动物模型肿瘤的生长。利用该抑制剂作为药理性探针,我们发现CBS酶负调细胞铁死亡的全新分子机制。针对H2S产生酶CSE,我们也通过高通量药物筛选发现其第一个nM抑制剂,而且该抑制剂在体内可恢复失血性休克大鼠的血压,相关研究结果已封面论文形式发表在J.Med.Chem(2019)上。针对细菌H2S产生酶,我们也通过筛选26,000化合物,发现了该酶第一个特异抑制剂,进一步证实该抑制剂通过提高细菌内ROS水平从而提高抗生素的杀菌效果(Cell Chem. Biol. 2020, Cover Story)。针对幽门螺旋杆菌NH3产生酶Urease,通过高通量筛选发现了几个nM抑制剂,其可通过竞争底物或别构方式抑制该酶活性(The FASEB J 2021)。
针对糖基转移酶新靶点GalNAc-T我们发现了一类黄酮类天然产物(Luteolin、Quercetin和Myricetin)可高效抑制该酶活力,为该酶的第一个底物竞争型抑制剂 (Liu F. and Xu K. et al, J. Bio. Chem 2017), 该抑制剂可有效抑制老年痴呆症APP/PS小鼠模型内Abeta的含量。通过系统分析和总结该抑制剂的结合模式和该类酶的晶体结构,我们发现了其酶活调控的新机制(ChemBioChem, 2018; Invited Review)。针对帕金森症药物靶点DDC(B6酶)从西双版纳植物Euonymus glabra Roxb.和Horsfiedia genus提取物中分离得到了结构全新的天然产物抑制剂 (Ren J.# and Zhang Y.# et al, ACS Chem Biol, 2014, Cover Story; Rui Z.#, Hu Y.# et al, Organic Letters. 2019);针对老年痴呆症靶点蛋白g分泌酶, 采用“老药新用”策略发现了老药喜得镇(HydergineÒ)可以抑制病人细胞内Abeta的产生(Sci Rep 2015)。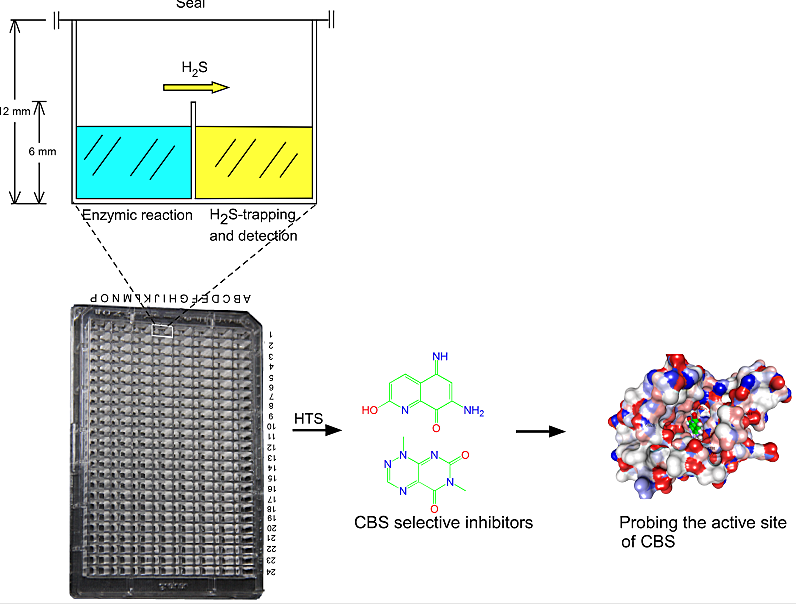
图1:基于192串联双孔板的筛选模型发现了第一个CBS特异抑制剂
高通量药物筛选模型
高通量药物筛选目前在制药界得到广泛的应用,是寻找药物先导物的常用方法之一。瑞士诺华公司的明星药物Gleevec正是这样被发现得到。构建创新的药物筛选模型是高通量药物筛选的首要保证。针对神经退行性疾病、细菌感染、免疫和肿瘤等疾病的酶蛋白靶标,我们构建了基于分子或细胞的高通量筛选模型。
气体信号分子NO、CO、H2S和NH3等的产生酶被认为是潜在的药物靶点。过去,由于没有高通量检测气体的方法,因此这些气体产生酶的高特异性的抑制剂或激活剂不能被系统高效地发现。我们通过改造384微孔板,将其两个相邻微孔的孔壁进行部分打通,从而构建成一个酶促反应和气体检测各自独立的具有“串联双孔”的192微孔板(见图1),首次实现了对气体分子H2S进行实时和高通量的检测。利用这个“串联双孔”板,我们对H2S气体合成关键酶CBS或CSE(B6酶;结肠癌等疾病的药物靶点)进行了小分子抑制剂的高通量筛选并得到第一个特异抑制剂(Zhou Y. et al,Chem Comm 2013)。类似的,基于192微孔板,我们发展了一种新型的脲酶NH3气产物检测的高通量并行方法。利用该方法,进行了脲酶抑制剂的第一次高通量筛选。
此外,针对糖基转移酶GalNAc-T和多巴脱羧酶(Dopa decarboxylase),我们采用双酶偶联的方法,构建了其高通量的酶活检测方法(Liu F. and Xu K. et al, J. Bio. Chem 2017; Ren J. et al, ACS Chem. Biol., 2014)。同时,我们也对多种酶构建了基于细胞的高通量筛选系统,为研究这些酶的功能和机制提供了工具和方法。
酶的功能研究和化学生物学
酶的分子催化机理、以及其在代谢、信号通路所起的作用很多还是未知。我们使用小分子探针工具和化学生物学方法研究这些未知且重要的生物学问题。利用结构多样的小分子化合物探针工具,结合分子模拟、酶动力学方法揭示酶结合底物和催化机制;利用高亲和力/共价小分子标记方法寻找疾病的靶点蛋白和酶的活性位点;利用具有生物活性的小分子探针工具研究新型信号通路机理和蛋白质后修饰调控等。目前,我们利用小分子探针工具CH004, 发现了其靶点CBS是细胞铁死亡的负调控开关(Cell death disease 2018);利用糖基转移酶抑制剂Luteolin,发现其活性调节Loop(activity-regulation-loop)构象是该酶活化的起始步骤(ChemBiochem 2018);利用NH3产生酶Urease抑制剂,发现该酶具有别构位点,且调控该位点的Cys残基可抑制该酶酶活(The FASEB J 2021)。
新型酶底物发现和其涉及的新信号通路研究
蛋白质的细胞内降解过程是一个复杂而重要的生物学问题。跨膜蛋白在细胞膜内被剪切成胞质片段进入细胞核起着转录调控的机制被称之为受调节的膜内蛋白裂解(Regulated Intramembrane Proteolysis,RIP)。哺乳细胞中,负责这一过程的是gamma-分泌酶膜蛋白,其底物包括APP等具有重要生物功能的膜蛋白,而这一过程被认为和神经退行性疾病以及肿瘤密切相关。
我们实验室利用小分子探针工具、分子遗传学、细胞生物学手段,研究膜蛋白的降解机理,去发现g分泌酶的新底物和其涉及的新信号通路,争取揭示疾病机理和治疗的生物学新机制。
前期研究中,我们发现AXL膜蛋白的稳态受alpha分泌酶、gamma分泌酶和蛋白酶体联合控制。AXL可被分泌酶剪切产生胞内片断ICD,该胞内片断可通过一个新发现的HRRKK的核定位信号入核进一步调控基因活力。临床在研药物R428可抑制AXL的磷酸化,打破膜上AXL含量的稳态调控,加速AXL经分泌酶剪切的代谢通路,从而下调AXL膜上的表达量。而抑制AXL的膜内剪切可显著增高非小细胞肺癌细胞对Tarceva®药物的耐药性。
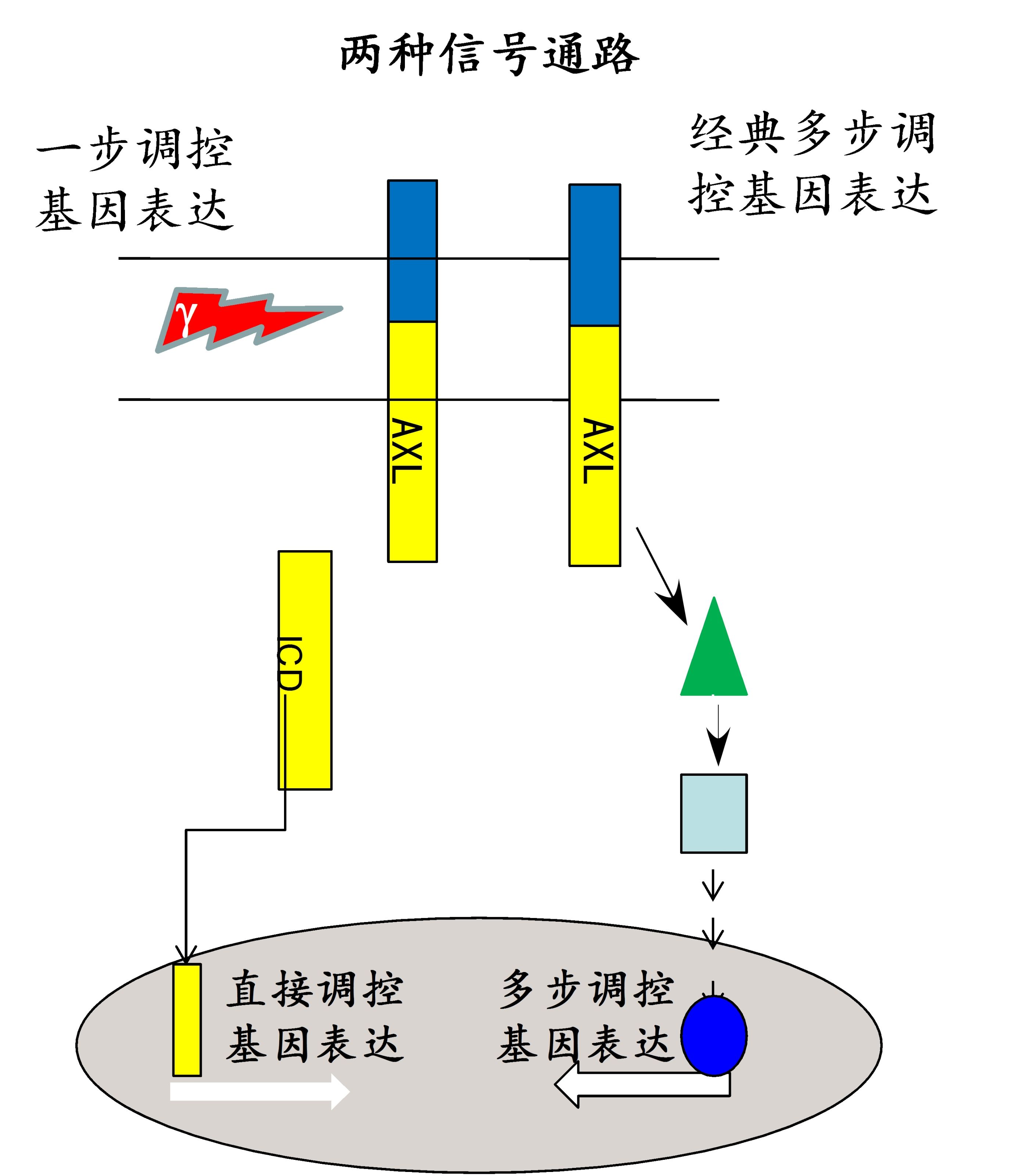
图2:经典地级联放大的信号通路和受膜内剪切调控的非经典转位信号通路。